최은택 기자/승인 2021.11.15 03:34
이달 건정심 서면심의 예상...2개 제제 12월 급여삭제
엔테론 안과 적응증, 약품비 환수협상 후속조치
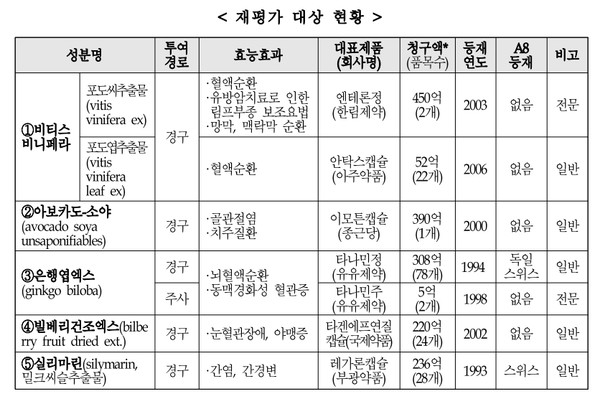
정부와 보험당국이 해외에서 건강기능식품으로 판매되고 있는 생약성분을 대상으로 실시한 기등재약 급여적정성 1차 본평가 1년여의 여정이 사실상 마무리됐다.
평가 결과에 따라 해당 제품들의 운명도 갈리게 됐는데, 제약사들도 '울고웃는' 날의 연속이었다.
시작은 비티스 비니페라(포도씨·포도엽추출물), 아보카도-소야, 은행엽엑스, 빌베리건조엑스, 실리마린 등 5개 제제였다. 건정심 제출 자료상 이들 제제의 연간 청구액은 1661만원 규모.
이중 은행엽엑스와 포도엽추출물은 재평가 대상약제 선정기준에 부합하지 않아 평가 도중 제외됐다. 이 과정에서 은행엽엑스 보유업체는 주사제 품목허가를 삭제하는 '묘수'를 썼다. 원료수급 등 제품을 계속 생산하기 어려운 문제가 있었다고는 하는데, 결과적으로 이 '묘수'는 통했다.
아보카도-소야도 1년 조건부 급여유지로 결정돼 기사회생했다. 임상적 유용성 입증이라는 조건을 충족해야 하지만, 정황상 큰 문제는 없을 것으로 보인다.
포도씨추출물은 적응증에 따라 평가결과가 갈렸다. 정맥림프 기능부전 증상개선(혈액순환)과 안과 관련 적응증(망막, 맥락막 순환)은 급여 유지되고, 유방암치료로 인한 림프부종 보조요법 적응증은 삭제될 예정이다.
5개 성분제제 중 빌베리건조엑스, 실리마린 등 2개 제제만 '완전하게' 퇴출 수순을 밟게 됐다. 빌베리건조엑스와 실리마린의 대표 품목은 국제약품의 타겐에프와 부광약품의 레가론. 이에 따라 이번 재평가로 예상되는 연간 약품비 절감액은 약 500억원으로 당초 정부 목표대비 3분의 1로 줄게 됐다.
복지부는 급여삭제 대상 약제에 대해서는 이달 중 건강보험정책심의위원회 서면심의에 붙여 의결하고, 12월1일부로 급여목록에서 삭제할 예정이다.
또 포도씨추출물의 안과관련 적응증은 식약처 임상재평가 대상이어서 약품비 환수협상이 이어질 전망이다. 복지부 관계자는 "(포도씨추출물에 대한) 환수협상 명령을 검토 중"이라고 했다. 건강보험 약제목록에 등재된 포도씨추출물은 한림제약의 엔테론이 유일하다.
'오늘의 제약뉴스' 카테고리의 다른 글
| '위기를 기회로' 제약산업을 이끄는 여성리더들 (0) | 2021.11.17 |
|---|---|
| 의약품 GMP 적합판정서 양도양수 등...이것이 궁금? (0) | 2021.11.17 |
| 공동개발 의약품...품목+제조원 변경 '이렇게 관리' (0) | 2021.11.15 |
| 마약류 오남용 우려...취급-사용 금지 제한 '이렇다' (0) | 2021.11.10 |
| 의약품 자료보호제도...미국-유럽-일본 제각각 (0) | 2021.11.10 |


