- 엄태선 기자
- 승인 2022.07.22 07:02
얀센 'JNJ-61186372' 3상...애브비 '엡코리타맙' 3상 시험도
서울아산병원 '옵디보'-암센터 'CKD-702' 연구자임상 진행

국내외 제약사들이 다양한 질환자를 대상으로 1~3상 임상시험을 진행, 의약품 개발에 뛰어들고 있다.
식약처의 임상시험승인 현황에 따르면 최근 국내제약사는 물론 다국적 제약사들이 앞다퉈 임상시험에 나섰다.
먼저 국내 제약사들을 보면 녹십자가 '정주용 헤파빅주(정맥주사용 B형 간염 사람면역글로불린)'에 대한 3b상 임상시험에 들어갔다. 간이식 환자를 대상으로 정주용 헤파빅주 직접정부의 안전성 및 유효성을 평가하기 위한 국내개발 제3b상 임상시험이다.
대웅제약의 자회사 아이엔테라퓨틱스도 '펙수클루정40밀리그램(펙수프라잔염산염)(DWP14012)'에 대한 1상 시험을 진행한다. 건강한 성인에서 'DWP14012'와 'DWC202202'를 병용 투여 시 DWP14012가 DWC202202의 약력학에 미치는 영향을 평가하기 위한 무작위배정, 공개, 3순서군, 3기, 교차 반복 투여, 제1상 임상시험이다. 국내개발로 서울대학교병원에서 이를 확인한다.
유한양행의 관계사인 면역항암제 개발기업 이뮨온시아는 'IMC-001'에 대한 임상 2상을 추진한다. 종양변이부담이 높은(TMB-H) 전이성 또는 국소 진행성 고형암 환자를 대상으로 IMC-001에 대한 국내개발 제2상 임상시험을 삼성서울병원에서 실시한다.
신풍제약도 'SPC1001'에 대한 2상 임상을 추진한다. 본태성 고혈압 환자를 대상으로 SPC1001 의 유효성 및 안전성을 평가하기 위한 다기관, 무작위배정, 이중눈가림, 평행, 국내개발 제 2 상(2b) 임상시험으로 차의과학대 강남차병원에서 그 유효성 등을 살핀다.
다국적제약사들도 항암제 개발에 열을 올리고 있다.
한국얀센은 'JNJ-61186372'에 대한 3상 시험에 나선다.
오시머티닙과 화학요법 중에 진행된 EGFR-돌연변이 진행성 또는 전이성 비소세포폐암이 있는 임상시험대상자를 대상으로 레이저티닙과 함께 투여하는 아미반타맙 피하 수동 주사를 아미반타맙 정맥 내 투여 또는 아미반타맙 피하 온바디 약물 전달 시스템과 비교하는 제3상, 라벨 공개, 무작위 배정 국외개발 임상시험이다.
이는 삼성서울병원과 서울아산병원, 서울대병원, 연세대세브란스병원, 화순전남대병원, 분당서울대병원, 국립암센터, 차의과학대분당차병원, 경상국립대병원에서 그 가능성을 찾는다.
한국애브비는 이중항체 '엡코리타맙(Epcoritamab)'에 대한 국외개발 3상을 승인받아 진행한다. 재발성 또는 불응성 소포림프종 환자를 대상으로 Rituximab 및 Lenalidomide(R2)와의 병합요법으로 투여되는 엡코리타맙의 안전성과 유효성을 R2와 비교 평가하는 제3상, 라벨 공개 임상시험을 실시한다.
실시기관은 부산대병원을 비롯해 계명대동산병원, 전북대병원, 인제대부산백병원, 동아대병원, 삼성서울병원, 서울아산병원, 분당서울대병원, 서울대병원, 서울성모병원에서 평가한다.
세엘진의 경우 'CC-92480'에 대한 국외개발 3a상을 진행한다. 재발성 또는 불응성 다발성 골수종(RRMM) 시험대상자를 대상으로 CC-92480, 보르테조밉 및 덱사메타손(480Vd)을 포말리도마이드, 보르테조밉 및 덱사메타손(PVd)과 비교하는 제3상, 2단계, 무작위배정, 다기관, 공개 임상시험이다.
이밖에 의료기관들의 연구자임상도 진행된다.
서울아산병원은 면역항암제 '옵디보(OPDIVO)'에 대해 항-PD-(L)1 억제제 치료 동안 진행한 진행성 고형암 환자를 대상으로 대변균총 이식술과 니볼루맙 병용 요법 2상 임상 연구를 진행한다.
국립암센터도 항암 이중항체인 종근당의 바이오신약 후보물질 'CKD-702'에 대한 연구자 임상을 진행한다. 위암의 3차이상 요법으로서의 CKD-702/이리노테칸 1b/2상 임상시험 및 동반진단 개발 임상이다.
국내외 제약 임상 '불 붙었다'...항암제 등 접근 다양 - 뉴스더보이스헬스케어 (newsthevoice.com)
'오늘의 제약뉴스' 카테고리의 다른 글
| [뉴스더보이스가 전하는 국내제약 단신-7월25일] (0) | 2022.07.27 |
|---|---|
| [뉴스더보이스가 전하는 국내제약 단신-7월26일] (0) | 2022.07.27 |
| 의료기기 책임보험제도...이것이 궁금하다 (0) | 2022.07.21 |
| '제약 임상은...ing'...한미약품 '순환기용치료제' (0) | 2022.07.21 |
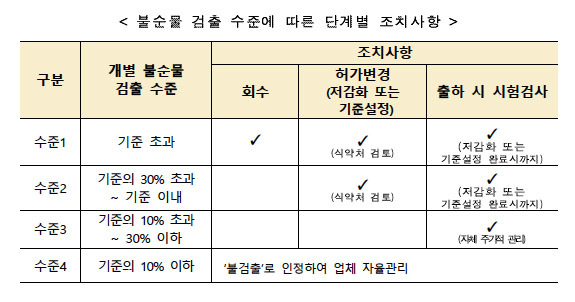
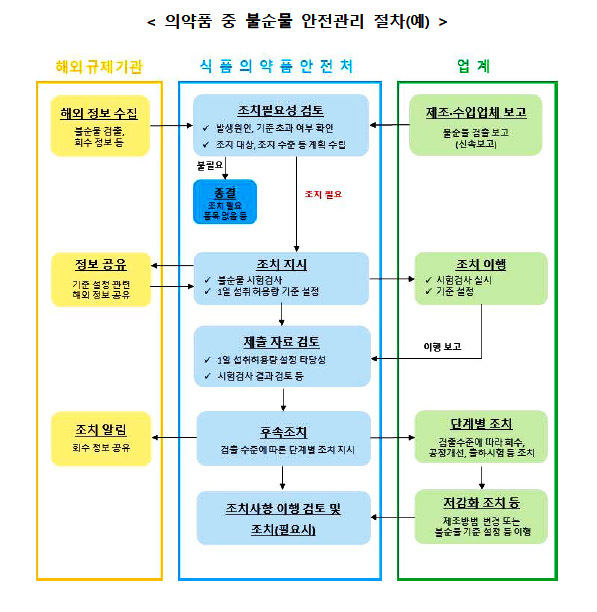
| 의약품 불순물 검출시...제약, 단계별 조치는? (0) | 2022.07.20 |