식약처, 14일 정책설명회 통해 추진방향 밝혀
2007년부터 2017년까지 10년간 정제는 물론 캡슐제, 좌제 대상으로 의약품 동등성(이하 의동) 확보 성분에 대한 재평가를 진행하고 이후 산제-과립제, 올해부터 점안제-점이제-폐흡입제-외용제제에 대한 재평가가 이뤄지고 있다.
특히 지난 2020년 의약품 등의 안전에 관한 규칙 개정에 따라 기존 특정 성분제형 품목에서 전 성분제형 품목으로 확대, 동등성 의무 의약품을 지속적으로 확대해 왔다.
식약처는 14일 의약품 재평가 정책설명회를 열고 향후 의동 재평가 추진 방향에 대해 구체적으로 설명했다.
앞서 경구용제제인 정제, 캡슐제, 산제, 과립제의 경우 의동 확보 외 성분에 대해 지난 4월15일부터 신규품목에 대한 동등성이 의무화 됐다. 기 허가 품목은 내년부터 2025년까지 재평가를 해야 한다. 여기에 시럽제와 액제는 전성분이 대상이며 신규 등록된 품목은 지난 4월15일부터 동등성을 의무적으로 적용되며 기허가 품목은 역시 내년부터 2025년까지 재평가를 해야 한다.
무균제제의 경우 점안제는 의동확보 외 성분, 주사제와 안연고제는 전성분을 대상으로 신규품목은 오는 10월15일부터 의무 시행된다. 기허가품목은 오는 26년부터 재평가에 들어간다.
기타 좌제나 점이제, 외용제제, 폐흡입제는 의동확보 외 성분이나 투성-관류제 등의 전 성분은 내년 10월15일부터 신규품목은 의무적으로 의동이 적용되며 기존품목은 26년부터 재평가를 해야 한다.
지난해 산제-과립제의 경우 139품목 중 대조약 지정 품목 등 34개품목을 제외한 오셀타이미르 등 105개 품목에 대해 사전 열람, 36개사 81개 품목에 대한 재평가를 공고했으며 지난해 6월말 그 결과를 공시한 바 있다.
올해는 점안제-점이제-폐흡입제-외용제제와 관련, 지난해 6월 111개사 379품목에 대한 재평가 실시를 공고했다. 대상품목은 점안제 레보플록사신 등 207품목, 점이제 오플록사신 등 7품목, 폐흡입제 살부타몰 등 18품목, 국소 외용제제 트레티노인 등 108품목, 저닌 외용제제 리바스티그민 등 39품목이었다.
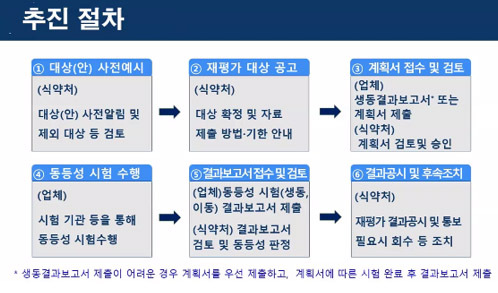
이와 관련 지난해 말 업체들이 재평가 자료 제출을 완료했으며 올해부터 식약처가 자료 검토에 들어갔으며 지난 5월말 재평가 자료 보완 요구를 했다.
주요보완사항은 대조약 선정의 타당성 입증자료, 첨가제 신청 사항에 대한 객관적 근거자료, 제제의 특성을 고려한 이하학적동등성 시험자료인 입자도, 방출시험, 점도, 점적용량, 유동학적특성 등에 대한 자료보완이다. 자료보완은 2개월로 오는 8월1일까지이다. 다만 연장사유서 제출할 경우 타당성을 검토 후 기간 연장이 가능하다.
그럼 내년부터 진행되는 의동 재평가는 어떻게 진행될까.
기본 추진 방향은 경구용에서 무균, 기타 제제로 순차적으로 진행되며 경구용은 정제, 캡슐제 등 약 6000품목은 3년 이내 재평가를 완료한다는 계획이다. 내년부터 2025년까지이다. 무균 및 기타는 주자세, 외용제제 등 약 4000품목은 2026년부터 계획 수립 및 추진한다는 방침이다.
내년에는 정제(나정), 2024년 정제(필름코팅정), 2025년 캡슐제와 과립제, 시럽제 등이, 2026년에는 주사제와 점안제, 외용제제 등의 순으로 재평가를 진행하게 된다.
세부계획을 보면 정제는 레보드로프로피진 등 130개 성분을 대상으로 올해 7월 예시한 후 12월 공고, 내년 3월까지 생동결가보고서 또는 계획서 제출, 내년 12월까지 생동결과보고서 제출, 2024년 결과공시하는 절차로 진행된다. 대상은 이달내 사전 안내하고 오는 12월 대상확정과 함께 공고를 할 예정이다.
이후 2024년 필름코팅정의 경우 암로디핀 등 420개 성분이 대상이며, 2025년 캡슐제-과립제-시럽제의 경우 피록시캄 등 286개 성분이 앞서 정제와 같은 절차로 진행딘다. 2026년 무균 및 기타 제제는 아세트아미노펜 등 984개 성분이 대상 재평가는 주사제, 점안제, 흡입제, 외용제제 등 순으로 실시 예정이며 2025년 세부계획 수립 후 정책설명회를 통해 공개된다.
2007년부터 시작된 의동 재평가...향후 어떻게 되나? - 뉴스더보이스헬스케어 (newsthevoice.com)