- 엄태선 기자/ 승인 2024.11.06 06:52
접수부터 예비심사, 전담팀 구성, 개시회의 등 담아

식약처가 내년부터 신약 허가시 그 수수료를 4억원으로 상향하는 관련 규정을 예고하고 업계의 의견조회를 진행하는 가운데 변경될 신약 관련 허가-심사 처리 절차를 담안 지침서를 공개해 주목된다.
식약처는 5일 '신약 품목허가-심사 업무절차(공무원 지침서)'를 공개했다. 단 이 지침서는 지난 10월 현재 유효한 법규를 토대로 작성돼 이후 최신 개정 법규 내용 등에 따라 달리 적용될 수 있다.
이 지침서는 접수부터 예비심사, 전담팀 구성, 개시회의, GMP 실태조사, 1~2차 보완, 중앙약심 회의, 최종회의 등 신약의 허가심사 전반 절차를 다았다.
먼저 접수는 허가 신청 민원 접수일(수수료 납부)이며 식약처는 단독심사, 수수료 경감 여부 등 검토 후 접수하게 된다. 접수 후 수수료 취소 불가하며 환불규정에 따른 환불은 예비심사 기간 중 80% 환불 등이 가능하다. 필요한 경우 접수 전 향후 진행 절차 등 사전협의도 가능하다.
예비심사는 접수 후 7일 이내(캘린더데이, 이하 동일)이며 식약처는 제출자료 요건 확인, 미제출 자료가 있는 경우 민원인에게 제출 요청(MMS 등)하게 된다. 민원인은 미제출 자료 통지받은 경우 개시회의 전까지 제출하게 된다.
또 전체 심사일정을 감안할 때, 개시회의 전까지 제출되지 못한 자료는 이후 임의제출이 어려우며 1차 보완대상으로 처리되므로, 이 경우 신속심사가 지연될 수 있음을 업체에 공지하게 된다.
이후 품목별 전담팀이 구성된다. 이는 접수 후 10일 이내이며 식약처는 신약 품목별 전담팀을 구성하게 된다. 팀장은 허가부서 과장, 품목관리자는 허가부서 담당자, 안유‧품질‧RMP‧GMP‧GCP 검토자가 포함된다.
개시회의는 접수 후 14일 이내이며 허가심사‧GMP‧GCP‧중앙약심 등 전체 일정 조율, 전담팀 소개, 신청개요 및 추가 필요 자료 등이 안내된다. 회의방법은 대면(오송), 화상, 또는 대면-화상이 병행된다. 회의결과는 회의일로부터 10일 이내에 민원인에게 통지된다.
아울러 GMP실태조사가 이뤄진다. 접수일부터 90일 이내이며 민원인 사정으로 실태조사가 연기되는 경우 허가가 지연될 수 있음을 사전에 공지된다.
GCP실태조사도 함께 진행된다. 1차 보완 이후 60일 이내이며 이 역시 민원인 사정으로 실태조사가 연기되면 허가가 지연될 수 있음을 사전에 공지하게 된다.
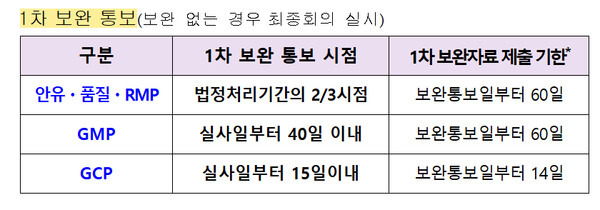
이어 1차 보완 통보되며 보완이 없는 경우 곧바로 최종회의가 실시된다.
안유-품질-RMP의 경우 1차 보완 통보 시점은 법정처리기간의 2/3시점이며 1차 보완자료 제출 기한은 보완통보일부터 60일이다. GMP는 실사일부터 40일 이내에 1차 보완 통보되며 1차 보완자료 제출 기한도 역시 보완통보일부터 60일이다. 여기에 GCP는 실사일부터 15일이내에 1차 보완 통보되며 보완통보일부터 14일내 관련 자료를 제출해야 한다. 물론 민원인은 제출기간 2회 연장 가능하며 연장기간 사유에 대해 식약처 검토 후 승인된다.
1~2차 보완요청에 대해 모두 설명회의가 있다.
1차 보완요청 설명회의는 보완요청일부터 2~3주 이내 이뤄지며 식약처의 보완요청 상세내용, 요구자료 종류, 범위, 요건 등이 민원인에게 설명되고, 민원인 질의에 답변이 진행된다. 회의결과는 회의일로부터 10일 이내에 민원인에게 통지된다.
또 1차 보완제출자료 사전등록 및 설명회의 요청(2회, 민원인 선택)도 가능하다. 시점은 보완기간의 1/2경과 시점까지 요청(최소 보완완료일 30일 이전까지)이 가능하다. 필요한 경우 민원인은 보완자료 제출기간 2회 연장이 가능하다. 민원인은 보완제출자료 시스템에 사전등록하면서 식약처에 설명회의 개최를 요청할 수 있으며 식약처는 사전등록 자료를 검토하게 된다.
민원인이 1차 보완제출자료 설명회의를 선택할 경우 보완자료 사전등록일부터 3주 이내에 진행된다. 민원인은 사전등록한 보완제출자료에 대해 설명하고, 식약처는 그 검토결과를 설명하는 등 사전등록 자료에 대한 논의를 하게 된다. 회의결과는 식약처가 회의개최일부터 10일 이내 문서로 통지된다. 민원인 사정으로 회의가 연기되는 경우 허가가 지연될 수 있음을 사전에 공지된다.
1차 보완제출자료 접수는 법적보완기간 이내이며 '목표허가일-60일' 이전 보완자료제출 시 신속처리가 가능하다. 민원인은 사전등록 결과 등을 반영해 보완제출자료 시스템에 접수하고 식약처는 보완제출자료를 검토하게 된다.
2차 보완 통보는 법정처리기한일 이전 10일까지 이뤄지며 보완 없는 경우 최종회의를 실시하게 된다. 보완자료 제출기간은 보완통보일부터 10일이며 제출기간 연장은 불가하다.
민원인이 2차 보완요청 설명회의를 2차 보완통보일부터 5일 이내에 요청할 경우 식약처의 보완요청 상세내용, 요구자료 종류, 범위, 요건 등이 설명되고, 민원인 질의에 답변하게 된다. 회의는 대면(오송), 화상, 또는 대면-화상 병행되며 회의일부터 10일 이내에 신청인에게 회의결과를 통지하게 된다.
2차 보완제출자료 접수는 2차보완통보일부터 10일 이내이며 보완제출자료 시스템에 접수하게 된다. 식약처는 보완제출자료를 검토하게 된다.
식약처는 필요시 중앙약사심의위원회 등 전문가 회의를 하게 되며 이는 최종회의 2주전까지 개최하게 된다. 필요시 처리기간 연장을 통지하게 된다.
허가 마지막 관문인 최종회의는 허가목표일 5일 이전에 진행된다. 식약처는 최종 허가심사 결과 내부 논의하게 된다. 회의결과는 민원 처리 공문으로 발송된다. 허가부서 최종 민원 처리(법정처리기간 내)는 허가목표일이며 식약처는 처리 알림공문 발송, 적합 시 전자허가증을 발급하게 된다.
'오늘의 제약뉴스' 카테고리의 다른 글
| 마더스 '역류식도염제'-테라젠이텍스 '혈전제' 위탁품목 회수 (0) | 2024.11.07 |
|---|---|
| 그래프로 보는 제약기업 지난 10년 성적표(51)...비보존제약 (0) | 2024.11.06 |
| 국내제약 순조로운 성장세 지속...일부는 매출 역주행도 (0) | 2024.11.05 |
| 셀트리온 'CT-P42' 임상시험 뭐가 문제지?...국회 확인요청 (0) | 2024.11.01 |
| '제약 임상은...ing'...대웅제약 '본태성 고혈압치료제' (1) | 2024.10.31 |
