엄태선 기자/ 승인 2021.07.23 06:47
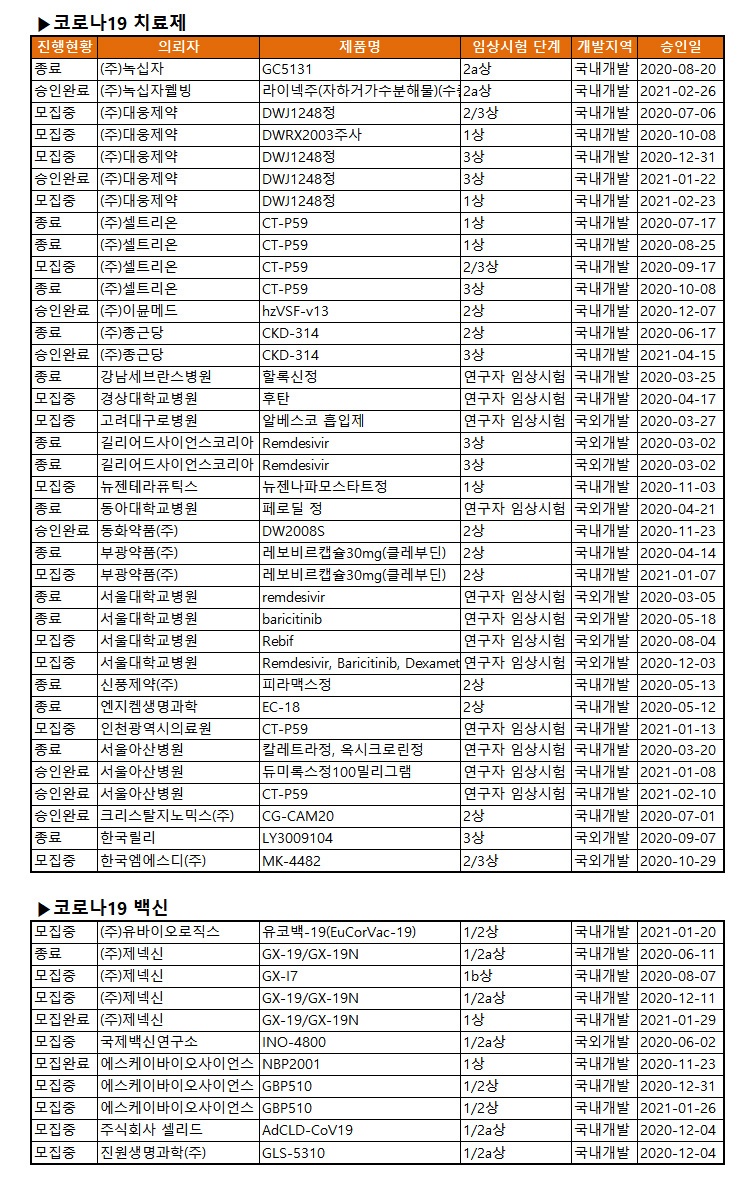
2상 10건, 1상 10건, 3상 7건...연구자임상 12건 최다
대웅제약 5건, 셀트리온-제넥신-서울대병원 각 4건
종료 22건, 모집중 12건, 승인완료 10건, 모집완료 9건

국내에 허가된 백신은 총 5건이며 코로나치료제는 2건에 불가했다. 코로나19 확산 1년반이 된 현 시점에서의 성적표이다.
백신은 한국아스트라제네카의 에스케이바이오사이언스 위탁 '한국아스트라제네카코비드-19백신주'와 수입품인 '아스트라제네카코비드-19백신주', 한국화이자제약의 '코미나티주', 한국얀센의 '코비드-19백신얀센주', 녹십자가 수입하는 '모더나코비드-19백신주' 등 6품목이 허가됐다.
치료제는 지난해 7월 길리어드사이언스코리아가 '베클루리주정맥주사용동결건조분말'(렘데시비르)를 허가받은 후 국내 제약 최초 셀트리온이 '렉키로나주960mg'를 허가받으면서 이름을 올렸다. 그 이후 아직까지 코로나19 치료제는 등록되지 않았다.
그럼 현재 백신과 치료제를 개발하기 위해 국내외 제약사 등이 진행하는 국내 임상시험 현황은 어떨까.
많은 국내제약사들이 의미있는 효과와 안전성을 기대하면서 임상시험에 뛰어들었다. 하지만 단계별 시험성적이 눈에 띈 결과물이 내놓지 못하는 일이 거듭 나오고 있는 상황이다.
22일 기준 식약처의 현재 임상시험 현황을 보면 전체 53건 임상 중 단계 종료 임상은 22건, 환자 모집중 12건, 임상 진행 승인은 10건, 환자모집 완료 9건이었다.
단계별로 보면 1상 10건, 2상 10건, 3상 7건이었으며 연구자임상 12건으로 가장 많았다. 이어 1/2상 3건, 1/2a상 5건, 2/3상 3건, 2a상 2건, 1b상 1건이었다.
임상 의뢰자로 보면 총 33곳이 임상을 진행했다. 대웅제약이 5건으로 가장 많았고 셀트리온과 제넥신, 서울대병원이 각 4건, 에스케이바이오사이언스와 서울아산병원 3건순, 종근당과 부광약품, 길리어드가 각 2건씩이었다. 녹십자 등 나머지 24개 의뢰자는 모두 1건씩이었다.
지역별로 보면 국내개발은 40건, 국외는 13건이었으며 백신은 8개 의뢰자가 13건을, 25개 이뢰자 40건은 모두 치료제 개발에 뛰어들었다.
백신 임상을 보면 유바이오로직스가 '유코백-19' 1/2상을, 제넥신이 'GX-19/GX-19N'의 1/2a상 2건, GX-I7 1b상을, 국제백신연구소가 'INO-4800' 1/2a상, 에스케이바이오사이언스가 'GBP510' 1/2상 2건과 'NBP2001' 1상을 진행중이다. 에이치케이이노엔이 'IN-B009주'의 1상을 22일(어제) 승인받았다.
또 셀리드가 'AdCLD-CoV19' 1/2a상, 큐라티스 'QTP104' 1상, 진원생명과학 1/2a상이었다.
한편 다국적 제약사는 모두 치료제만 개발중이었다. 한국엠에스디 'MK-4482' 2/3상을, 한국릴리 'LY3009104' 3상, 길리어드 '렘데시비르' 3상, 글락소스미스클라인 'VIR-7831(GSK4182136)' 2상 시험을 진행중이다.
국내 제약사는 녹십자를 비롯해 녹십자웰빙, 대웅제약, 셀트리온, 이뮨메드, 종근당, 텔콘알에프제약, 뉴젠테라퓨틱스, 동화약품, 부광약품, 신풍제약, 엔지켐생명과학, 크리스탈지노믹스, 한국유나이티드제약이 개발에 나서고 있다.
"대규모 환자 모집 문제 해소...백신개발 수월해졌다"
이렇게 많은 업체들이 개발에 뛰어들었지만 실제 시험 참여 환자를 모집하기가 쉽지 않다는 목소리가 초기 흘러나오기도 했다. 하지만 최근 정부가 현재 허가받은 백신과 비교임상이 가능하도록 조정하면서 환자모집의 어려움은 크게 해소된 것으로 나타났다.
백신 개발에 뛰어든 모 제약사 관계자는 "백신 개발에 나선 국내 제약사들이 초기에는 환자모집에 어려움을 호소했었다"면서 "현재는 정부가 기존 타사 백신과의 비교해서 연구할 수 있도록 해줬기 때문에 기존 환자모집 규모가 3~4만명에서 3000~4000명으로 크게 줄 수 있어 일정부분 문제해결이 됐다"고 설명했고 현재 진행되는 자사 백신개발 임상은 수월하게 진행되고 있다고 덧붙였다.
반면 치료제 개발에는 몇몇 국내제약사가 허가에 고배를 마시면서 다소 위축되는 분위기이지만 여전히 활발한 모습이다. 유나이티드제약 등 일부 제약의 경우 최근 유행중인 델타바이러스에 대한 효과를 확인하는 등 적지않은 성과를 내놓고 있어 점차 기대감을 높이고 있다. 첫 국내 백신과 두번째 국내 치료제가 허가되는 날이 다가오고 있는 것이다.
http://www.newsthevoice.com/news/articleView.html?idxno=21123
'오늘의 제약뉴스' 카테고리의 다른 글
| '투명한 임상시험', 애브비ㆍ암젠 등 7곳 '백점 만점' (0) | 2021.07.23 |
|---|---|
| 무좀치료 위해 먹은 '이트라코나졸'...구역, 구토 등 발현 (0) | 2021.07.23 |
| "제네릭이어도 최초라면"...8월 주목되는 신규등재 약제들 (0) | 2021.07.22 |
| 종근당의 미래...면역항암제 등 신약-개량신약 가능성 풍부 (0) | 2021.07.22 |
| (수첩)대웅 도덕적 해이?...'알비스D' 살리려다 소 잃어 (0) | 2021.07.21 |