- 엄태선 기자/ 승인 2023.05.11 07:15
식약처가 최근 몇 년동안 승인한 임상시험계획 및 변경시 보완율이 무려 70% 안팎에 이르는 것으로 나타났다.
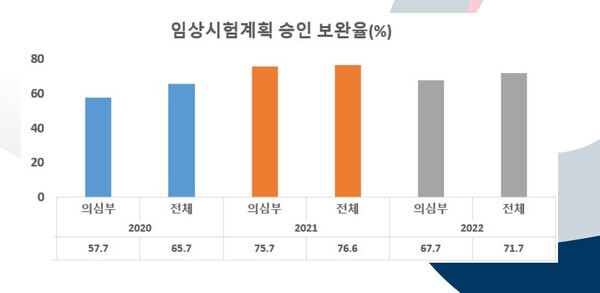
식약처가 최근 공개한 20~22년 임상시험계획-변경 승인 심사 보완율에 따르면 2020년 보완율은 의심부 57.7% 등 전체 65.7%에 이르렀다.
이어 2021년 의심부 75.7% 등 전체 76.6%까지 치솟았으며 지난해는 의심부 67.7% 등 전체 71.7%의 보완율을 보였다. 이는 10의 7은 보완사항이 나온다는 결과이다.
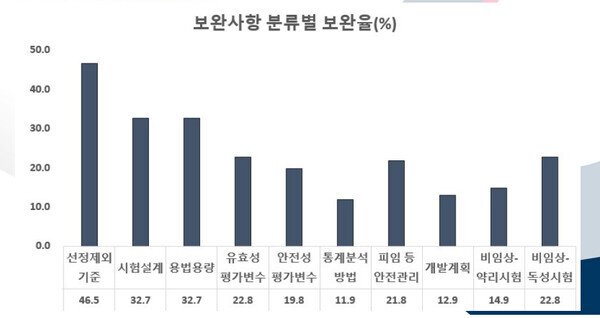
지난해 보완사항을 보면 선정제외기준이 46.5%로 가장 많았으며 시험설계와 용법용량이 각 32.7%, 유효성평가변수와 비임상-독성시험이 각 22.8%, 피임 등 안전관리 21.8%, 안전성평가변수 19.8%, 개발계획 12.9%, 통계분석방법 11.9% 순이었다.
보완예시를 보면 선정-제외기준의 경우 대상 환자의 진단기준 명확화가 지적, 대상 암종의 진단 및 등급을 최신 기준으로 적용하고 OOO의 조직병리학적 세부유형 기재가 주문됐다.
임상시험설계의 경우 눈가림 관련, 시술자 및 평가자 눈가림 방법에 대해 추가 기술, 시험약과위약의 성상이 상이하므로 눈가림을 유지할 수 있는 방법을 마련할 것이 요구됐다.
용법-용량의 경우 병용약물 관련, 병용금기약물 중 시험약과의 상호작용이 예상되는 약물이 일부 누락됐으므로 기허가사항을 고려해 해당약물 추가가 보완됐다.
유효성 평가항목의 경우 평가방법과 관련, 유효성 평가변수의 평가자 및 평가방법을 구체적으로 기술할 것과 OOO의 평가방법을 명확하게 기술할 것, 독립된 평가자 3인의 개별평가에 따른 대상자별 최종 평가에 대한 기준을 명확히 설정할 것이 주문됐다.
안전성 평가항목의 경우 평가항목 설정과 관련, 고칼륨혈증 등 시험약의 이상반응을 감안해 임상실험실 검사항목에 전해질 관련 항목을 추가 설정할 것 등이 보완됐다.
통계분석방법의 경우 시험대상자 수 산출 관련, 임상적 타당성 등 비열등성 마진 설정 근거에 대한 추가자료를 제출할 것 등이 보완됐다.
피임 등 안전관리의 경우 임상시험용 의약품 투여 종료 후 피임기간이 설정되지 않으므로, 약물의 반감기를 고려해 이를 설정할 것 등이 주문됐다.
개발계획의 경우 복합제 개발의 타당성 관련, 각 단일 성분의 예측 작용 기전과 개발하고자 하는 적응증과의 임상적 관련성에 대한 근거 제시 등이 보완됐다.
비임상-약리시험의 경우 효력시험자료와 관련, 각 단일 성분이 복합치료에 기여함을 확인할 수 있는 효력 시험자료 또는 타당한 설명자료 등이 보완됐다.
비임상-독성시험의 경우 생식발생독성과 관련, 만 12세 이상의 소아가 임상시험에 포함되나 발육기 독성시험이 미제출 등이 보완대상에 올랐다.
의약품 임상시험계획-변경 승인 심사시 '10의 7'은 보완요청 - 뉴스더보이스헬스케어 (newsthevoice.com)
'오늘의 제약뉴스' 카테고리의 다른 글
| 광동-제일-유나이티드 순성장...씨젠, 충격적 추락세 (0) | 2023.05.15 |
|---|---|
| 연구개발비에는 가득..판촉-학술 등엔 짜게 쓴 동아ST (0) | 2023.05.11 |
| JW중외-알리코-진양 크게 날갯짓...일동은 여전히 늪 (0) | 2023.05.11 |
| 1분기 두 자릿수 성장...셀트리온-동아쏘시오-휴온스 (0) | 2023.05.09 |
| 그래프로 보는 제약기업 지난 10년 성적표(8)...JW중외제약 (0) | 2023.05.08 |
