- 엄태선 기자
- 승인 2022.04.20 06:36

국내외 제약사들이 연이어 임상시험을 통해 항암제 개발 등에 힘을 쏟고 있다.
식약처에 따르면 다국적제약사들은 최근 방광암을 비롯해 난소암, 대장암, 전립선암 환자를 대상으로 한 임상시험을 추진한다.
먼저 한국화이자제약은 'PF-07225570'의 국외개발 1상 임상을 실시한다. 재발성 비근침윤성 방광암 시험대상자를 대상으로 단독요법 또는 항-PD-1 항체와의 병용요법으로서PF-07225570의 제1상, 공개, 용량 증량 및 확장 임상시험 1상이다. 분당서울대학교병원과 서울대학교병원에서 이를 확인한다.
한국엠에스디는 'MK-4830'과 '키트루다주(펨브롤리주맙, 유전자재조합)'에 대한 임상 2상을 진행한다. 고등급 장액성 난소암에 대한 신보조 치료로서 MK-4830을 병합하거나 병합하지 않은 펨브롤리주맙과 화학요법을 평가하는 무작위배정, 제2상 임상시험을 실시한다. 서울대학교병원과 연세대세브란스병원이 실시기관으로 참여한다.
한국릴리는 2건의 임상을 식약처로부터 승인받았다.
'LY3074828'에 대한 3상으로 국외개발로 진행한다. 중등증에서 중증의 궤양성 대장염 또는 크론병이 있는 소아 청소년에서 미리키주맙의 장기적 유효성과 안전성을 평가하는 제 3상, 다기관, 공개, 장기 연장 시험을 위한 마스터 임상시험계획서 3상이다. 삼성서울병원과 칠곡경북대병원, 서울대병원에서 그 안전성 등을 살핀다.
또 한국릴리는 '아베마시클립(LY2835219)'에 대한 3상 임상도 함께 진행한다. 고-위험 전이성 호르몬-민감성 전립선암이 있는 남성을 대상으로 아비라테론+프레드니손과 병용한 아베마시클립의 제 3상, 무작위 배정, 이중 눈가림, 위약 대조 시험이다. 국외개발로 서울대병원과 서울아산병원, 연세대세브란스병원, 삼성서울병원이다.
국내제약사인 종근당과 제일약품도 국내개발 임상을 진행한다.
종근당은 'CKD-331'에 대한 1상 임상을 진행한다. 건강한 성인 자원자를 대상으로 CKD-331의 안전성과 약동학을 평가하기 위한 공개, 무작위배정, 단회투여, 2군, 4기, 교차설계 임상시험이다. 에이치플러스 양지병원에서 이를 확인한다.
제일약품은 'JLP-2008'에 대한 1상을 추진한다. 건강한 성인을 대상으로 JLP-2008 단독투여시와 JT-001 및 JT-002 병용투여시 약동학적 특성 및 안전성을 평가하기 위한 무작위배정, 공개, 공복, 단회 경구 투여, 2군 2기 교차 임상시험이다. 차의과학대학교분당차병원에서 실시한다.
화이자-엠에스디-릴리-종근당-제일, 1~3상 줄 잇다 - 뉴스더보이스헬스케어 (newsthevoice.com)
'오늘의 제약뉴스' 카테고리의 다른 글
| 동화약품, 의료기기가 살렸다...잇치-활명수 지원자로 (0) | 2022.04.21 |
|---|---|
| 한올-삼아-일동-일양-사노피..."우리 품절 있어요" (0) | 2022.04.20 |
| '제약 임상은...ing'...메디포스트 '무릎 골관절염치료제' (0) | 2022.04.19 |
| 수입의존도 높은 국가필수약 우선 개발...닻 올랐다 (0) | 2022.04.19 |
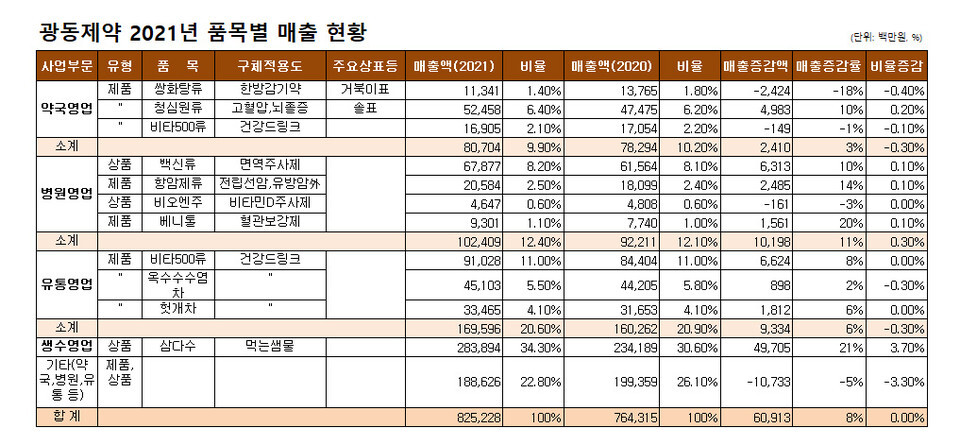
| 광동, 청심원-면역주사제로 끌고 비타500-삼다수로 밀고 (0) | 2022.04.18 |