- 최은택 기자
- 승인 2021.04.28 08:00
심사평가원-의약품안전원 12월부터 시범사업
중증 피부이상반응 유발 다빈도 5개 성분
정보제공 동의한 환자 42명에 적용 중
"동 수진자는 해당 의약품 사용 후 부작용을 경험한 환자입니다."
정부가 의약품 피해구제금을 지급받은 환자의 부작용 정보를 DUR시스템으로 의약사에게 안내하는 내용이다.
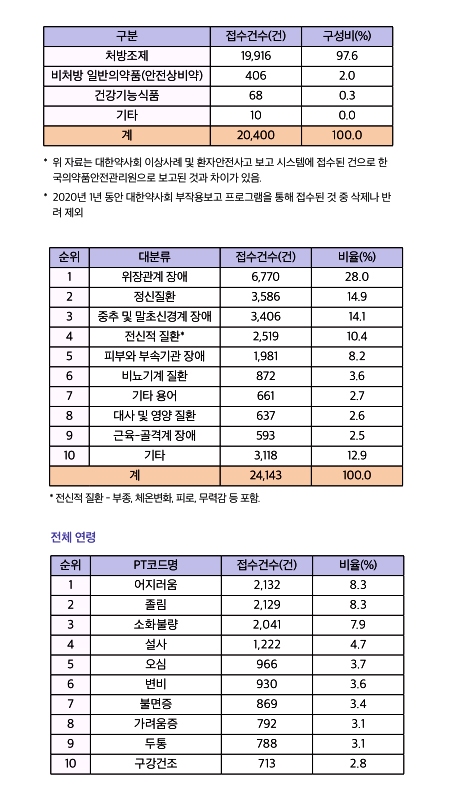
27일 국회에 따르면 보건복지부(건강보험심사평가원)와 식품의약품안전처(한국의약품안전관리원)는 협업을 통해 환자의 부작용 정보를 DUR시스템으로 제공하는 시범사업을 지난해 12월부터 실시하고 있다.
대상은 통풍치료제(allopurinol), 항경련제(carbamazepine, oxcarbazepine, phenytoin, lamotrigine) 등 중증 피부이상반응 유발 다빈도 5개 성분(354개 품목)이다. 의약품안전관리원은 의약품 부작용 피해구제 지급이 결정된 환자에게 해당 성분과 관련된 부작용 정보를 DUR 시스템을 통해 전달한다.

해당 환자가 동의해야 정보 제공이 가능한데 올해 3월말 현재 42명이 관련 정보를 제공받고 있다.
처방·조제 시 알림 정보는 "동 수진자는 해당 의약품 사용 후 부작용을 경험한 환자입니다"라는 문구와 함께 의약품 성분명, 부작용명, 부작용 발생일, 관련 문의 전화번호 등이 포함된다.
복지부는 알림정보를 통해 의사·약사가 해당 환자에게 부작용 유발 우려 의약품을 처방·조제하는 경우 DUR시스템을 통해 기 발생한 부작용, 의약품 성분 및 부작용 발생일을 확인할 수 있게 돼 재복용을 방지할 수 있을 것으로 기대하고 있다.
하지만 최근 3개월간 아직 정보제공 사례는 나오지 않은 것으로 확인됐다.
실제 작년 12월17일부터 올해 3월18일까지 시범사업 참여자 42명 중 38명이 의료기관에 내원해 327건을 처방받았고 이 과정에서 DUR 점검이 이뤄졌다. 하지만 5개 성분 정보제공(팝업)은 단 한 건도 없었다. 5개 성분 약제가 처방에 포함되지 않았기 때문으로 보인다.
한편 2015년 부작용 피해구제 사업 시행 이후 총 502건에 대해 피해구제 지급 결정이 이뤄졌다. 지금액은 84억7800만원 규모다.
지난해의 경우 사망일시 보상금 10건 10억7700만원, 장례비 10건 9200만원, 장애일시 보상금 5건 3억1600만원, 진료비 137건 4억8900만원 등 총 162건에 대해 19억7400만원의 피해구제금이 지급됐다.
'다양한 보건의료뉴스' 카테고리의 다른 글
| 혈우병약도 A5 조정평균가 대비 반값 아래로 급여 (0) | 2021.05.03 |
|---|---|
| 면역항암제 6개 적응증 유지 검토...티쎈트릭 첫 관문 통과 (0) | 2021.04.29 |
| 복지부, 간호업무 전담 '간호정책과' 신설...인력 3명 증원 (0) | 2021.04.27 |
| 공공병원 확충 팔 걷은 정부...진주권 지방의료원 '예·타면제' (0) | 2021.04.26 |
| 항암제, 덧셈만 하는 제약사...뺄셈도 해보는 의료계 (0) | 2021.04.23 |