최은택 기자/ 승인 2021.11.05 07:46
홍지형 교수, 심평원 심포지엄서 언급..."환자 접근성 강화 연계"
심사평가원 '2021 혁신연구 심포지엄'(1)
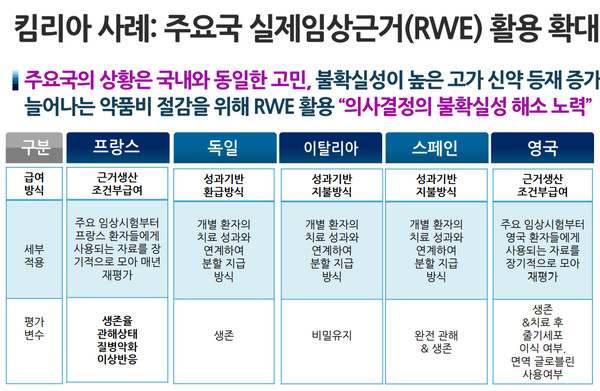
영국의 헬스케어 관리기구인 NICE는 급여 의사결정에서 최근 실제임상자료(RWD) 활용을 강화하는 걸 주요목표 중 하나로 발표하는 등 관심이 매우 높은 것으로 나타났다.
하지만 활용 측면에서는 아직 무작위 임상시험(RCT) 선호를 명시하고 있고, 불확실성이 큰 항암제와 희귀질환치료제 조건부 급여에 제한적으로 활용되고 있는 파악됐다.
홍지형 가천대학교 의료경영학과 교수는 4일 심사평가원이 '의약품 등의 급여관리를 위한 실제임상자료(RWD) 수집체계 구축방안'을 주제로 개최한 '2021 혁신연구 심포지엄'에서 '영국의 RWD 통합관리와 활용'을 RWE를 활용하고 있는 해외사례로 발표하면서 이 같이 밝혔다.
홍 교수에 따르면 NICE는 2020년 발표에서 의사결정 과정에서 RWE 활용을 강화하겠다고 했고, 이어 2021년에는 'NICE 전략 2021~2026년'을 통해 RWE 활용강화를 주요목표 중 하나로 제시했다.
하지만 가이드라인(2016년)에서는 여전히 RCT 선호를 명시하고 있고, RWE 활용은 불확실성이 큰 항암제와 희귀질환치료제의 조건부 급여에 제한적으로 활용하도록 하고 있다. 항암제 등의 환자 접근성 강화를 위한 것인데, 이는 한국의 위험분담제와 유사한 MAA(managed access agreement)를 통한 것이고, MAA 기간 동안 RWE를 포함한 추가자료를 수집해 재평가가 이뤄진다.

MAA 주요 사전 합의사항은 자료수집기간, 환자 적격, 임상적 불확실성 영역, 자료원(제약사 추가 임상시험 등), 결과지표, 자료분석 계획, 자료 오너십, 최종보고서 출판 책임자, 자료보호 등이다.
NICE는 항암제기금(CDF)와 관련해 제약사와 추가 자료 수집, 급여관련 사항 등에 합의하기도 했다. MAA 적용 약제의 경우 불확실성 해소를 위한 자료를 수집하고, 해당 기간동안(2년 또는 그 이상) 급여 수준을 결정하는 내용이다. 자료 수집 후에는 재평가를 통해 NICE 최종 결정여부를 결정한다. CDF-MAA 자료 수집에 합의한 약제에 킴리아주도 포함돼 있다.
홍 교수는 또 영국은 고가 희귀질환치료제 급여를 위해 2013년 HST 프로그램을 도입해 평가하고 있는데 최근까지 15개 약제가 이를 통해 평가가 완료됐다. 주목되는 건 HST ICER 임계값은 10만~30만 프랑에 달한다는 점이다. HST에서도 불확실성이 큰 의약품의 경우 MAA를 통해 추가 자료를 수집하는데 HST 15개 약제 중 5개 약제가 추가 자료 수집 대상이다. 구체적으로는 졸겐스마, 브리네우라, 스트렌식, 트란스라르나, 비미짐 등이 해당된다.

홍 교수는 결론적으로 "영국은 NHS Digital을 중심으로 RED 이용 및 RWE 기반 의사결정이 활성화될 것으로 예상된다. NICE도 의사결정 과정에서 RWD 활용을 위해 노력했지만 활용도는 제한적이다. 아직은 항암제 및 희귀질환치료제 급여 결정 시 비용효과성이 불확실할 경우 MAA를 통해 추가자료를 수집에 RWD를 활용하고, 추후에 최종 권고 여부를 결정한다"고 했다.
http://www.newsthevoice.com/news/articleView.html?idxno=23519
'환자정책뉴스' 카테고리의 다른 글
| 산정특례 질환 39개 추가...중증건선 등록기준 개선 (0) | 2021.11.26 |
|---|---|
| "복권수익금으로 중증·희귀약 급여지원"...복지부-기재부 이견 (0) | 2021.11.12 |
| 더 촘촘하고 정교해진 재난적의료비 "목표액 420억 초과예상" (0) | 2021.11.01 |
| 폐렴 의증으로 치료 받았는데...폐암 4기라니 (0) | 2021.10.26 |
| 지난 1년동안 의약품 신속심사 대상 지정...총 17품목 (0) | 2021.10.22 |