- 엄태선 기자/ 승인 2024.02.19 06:57
영업이익, 종근당홀딩스 흑자전환...경동제약 적자전환

그동안 주요하게 영위해왔던 사업을 접으면서 급격한 매출하락은 물론 이익마저 크게 급락하는 제약사가 등장했다.
금융감독원에 지난 13일부터 16일까지 지난해 연간실적을 공개한 17개 상장기업들의 명암이 갈렸다.
특히 코로롱생명과학의 매출하강과 그에 따른 이익하락이 컸다. 매출은 1246억원을 기록해 전년동기 1924억원 대비 무려 -35.2%를 찍으며 가파른 하향곡선을 그렸다. 영업이익과 순익도 모두 적자로 전환하면서 저조한 실적을 기록했다. 이는 그간 시장확대를 꾀해왔던 수(水)처리제 사업을 접었기 때문이다.
이와함께 경동제약도 매출부터 이익까지 모두 급락세를 만들었다. 1627억원의 매출을 올렸지만 전년 1827억원 대비 -11%를 보이며 큰 폭 하락을 나타냈다.영업이익과 순이익도 적자로 돌아섰다.
경동제약은 임금 인상과 환율 상승으로 인한 직-간접 매출원가가 증가했고 신제품 개발에 따른 임상 비용의 증가로 기술개발비용이 증가해 영업이익의 감소로 이어졌다.
업체별로 보면 지주사인 대웅이 1조8138억원을 달성하면서 전년 1조6973억원 대비 6.9%의 성장을 보였다. 이는 자회사의 펙수클루와 엔블로 등 신약 출시 등이 반영된 이유다. 영업이익은 -5.7%, 순이익은 57.2% 증가했다.
역시 지주사인 종근당홀딩스는 8798억원의 매출을 달성해 전년동기 9090억원 대비 -3.2%를 기록했으나 이익은 적자에서 흑자로 전환하면서 규모보다는 실속을 챙겼다.
HK이노엔와 동아에스티는 잠시 성장은 쉬어가고 이익에 신경썼다. HK이노엔은 8289억원의 매출을 올려 전년동기 대비 -2.1%를, 영업이익은 659억원으로 25.5%, 순이익은 472억원으로 23.8% 증가했다. 동아에스티도 6052억원의 매출을 달성하며 전년대비 -4.8%의 증가율을 보였으나 영업이익을 17.2%, 순이익은 130.3% 늘었다.
휴온스와 휴젤, 환인제약은 두자릿수 고성장을 보이며 쾌속 행진을 이어갔다.
휴온스는 5520억원의 매출을 달성하며 전년대비 12.1%, 영업이익 34.6%, 순이익 119.9%씩 증가했다. 휴젤은 3197억원을 올리며 전년대비 13.5%, 영업이익 16.2%, 순이익 60.0% 늘었다. 환인제약은 2304억원의 매출을 달성하며 전년대비 15.8%, 영업이익 1.2%, 순이익은 25.4% 성장했다. 휴온스는 의약품 수출 증가가, 휴젤은 전 사업부문이 두루 성장한 게 기여했다.
1000억원대 제약사들은 경동과 코오롱생명과학의 경우 크게 울었고 여타 제약사들도 제각각이었다.
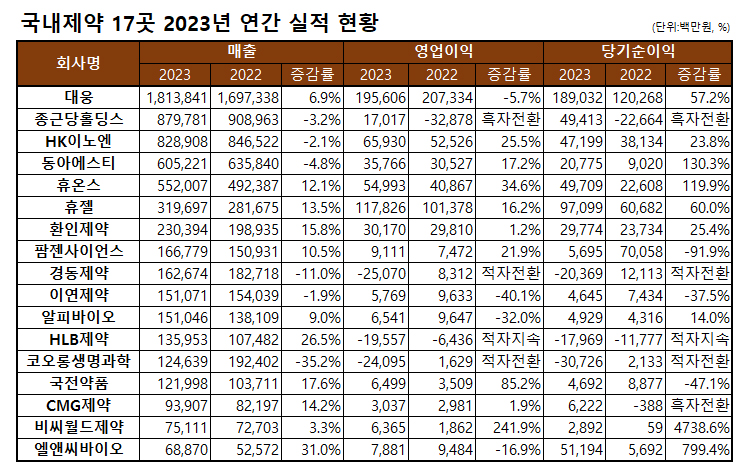
팜젠사이언스는 1668억원의 매출을 보이며 전년 대비 10.5%의 성장을 나타냈다. 영업이익도 21.9%를 기록했으나 순이익은 -91.9%를 보이며 추락했다. 주요 관계회사 이익감소의 영향을 받았다. 이연제약도 하향세를 그렸다. 이연은 1511억원의 매출을 달성하며 전년대비 -1.9%, 영업이익 -40.1%, 순이익 -37.5%로 저조했다. 이연은 연구개발비 증가 등으로 이익성적표가 좋지 않았다.
알피바이오는 1510억원의 매출을 올려 전년대비 9% 성장했으며 영업이익은 -32%, 순이익은 14% 성장했다. 이익은 원자자재상승과 인건비 증가가 반영됐다. HLB제약은 1360억원의 매출을 달성해 전년대비 26.5% 증가하며 고공행진을 했으나 영업이익과 순이익은 적자를 이어가며 알맹이가 없었다. 이익의 경우 건강기능식품 시장출시에 따른 판관비 증가로 순실이 컸다.
국전약품은 1220억원의 매출을 달성하면서 전년대비 17.6%의 성장했으며 영업이익도 85.2% 증가하며 기염을 토했다. 다만 순이익은 -47.1%로 주춤했다.
이밖에 1000억원 이하 제약사들은 전반적으로 실적이 나쁘지 않았다.
CMG제약은 939억원의 매출을 기록하며 전년 대비 14.2%, 영업이익 1.9%, 순이익은 흑자전환하면서 상향곡선을 그렸다. 비씨월드제약은 751억원의 매출을 올려 전년대비 3.3% 증가했다. 영업이익은 241.9%, 순이익은 4738.6%를 폭증했다. 엘앤씨바이오는 689억원의 매출을 달성하며 전년대비 31% 증가했다. 영업이익은 -16.9%, 순이익은 799.4% 증가하며 대조를 이뤘다.
CMG제약은 이자수익 증가와 지분법 이익 등에 다른 영업외 이익 증가가 순이익 증가로 이어졌으며 비씨월드는 신제품 및 주력 제품의 국내시장 점유율 확대 등이, 엘앤씨바이오는 신규거래처 발굴로 영업실적 개선과 관계기업 투자주식매각 등이 실적에 반영됐다.
사업중단으로 매출급락...국내제약들, 지난해 명암 갈려 - 뉴스더보이스헬스케어 (newsthevoice.com)
'오늘의 제약뉴스' 카테고리의 다른 글
| 약의 이면을 보다 '약의 빛과 그림자'...대한약품공업(30) (0) | 2024.02.20 |
|---|---|
| '제약 임상은...ing'...종근당 '전립선 비대증치료제' (0) | 2024.02.19 |
| 식약처 규제혁신 과제 180건...어떻게 진행되고 있나 (0) | 2024.02.19 |
| 오는 4월까지 품목갱신 안하면 퇴출...152개사 627품목 (0) | 2024.02.16 |
| '우리가 지켜야할 필수의약품'...혈액응고 치료제(1) (2) | 2024.02.16 |