- 엄태선 기자
- 승인 2022.06.20 06:22
희귀약 GMP 현지실사 지연 등 신속심사제 개선 주문도

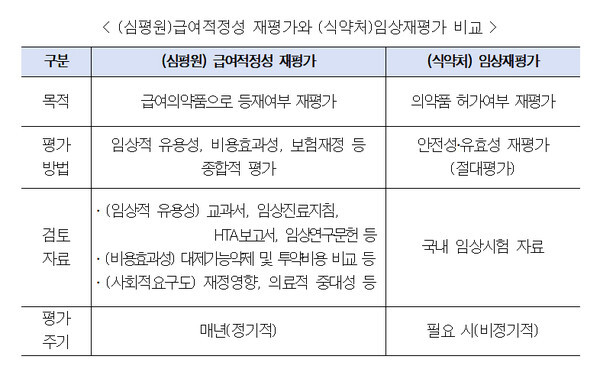
의약품 시판후 조사 등 재심사제도가 RMP(위해성관리계획)로 통합으로 통합하는 약물감시체계 개편작업이 속도를 낼 전망이다. 통합은 2024년 관련 규정 개정으로 완성될 예정이다.
식약처는 이를 위해 RMP 세부운영 지침을 올해안에 제정할 예정이다.
업계에 따르면 식약처는 이와관련 지난 17일 제약업계와의 소통채널 '팜투게더'를 열고 RMP통합을 위한 준비와 애로사항, 희귀약 GMP 현지실사 지연 등 신속심사제도 개선에 대해 의견을 나눴다.
이날 업계는 RMP통합과정에서 준비 및 애로사항에 대해 건의하고 시판후조사(PMS)의 현실적 개선을 주문한 것으로 알려졌다.
업계 관계자는 이와 관련 "RMP로 통합되더라도 PMS 등 재심사는 그 안전관리체계 속에 놓아있을 것"이라면서 "재심사의 경우 여전히 증례수나 조사기간 등에 있어 업계가 어려움을 토로하고 있는 실정이어서 약물이나 질환 특성을 반영한 탄력적 적용을 식약처에 주문했다"고 밝혔다.
이어 "현재는 재심사 기간이 4년, 6년 등 일관돼 있지만 실제임상자료(RWD) 등을 적극 활용할 경우 신약 등 재심사제도를 보다 유연하게 적용할 수 있을 것"이라며 "통합과정에서 다양한 약물리스크 등을 고려한 실질적인 시판후 안전관리제도로 탈바꿈되길 기대한다"고 덧붙였다.
또 "통합에 있어 업계의 의견을 능동적으로 반영하기 위한 협의체 구성도 논의됐다"면서 "향후 이를 전담할 논의체가 마련돼 운영될 것으로 보인다"고 설명했다.
이날 희귀약 허가를 위한 신속심사제도를 개선도 업계가 주목하는 부분이었다.
희귀신약이 전체 신약 허가 중 30% 수준에 이르는데 심사기간이 여전히 1년이상이라는 것이다.
이와 관련 업계 관계자는 "신약이나 희귀약을 허가받기 위해서는 기본적으로 현지 제조시설에 대한 실사가 필요하다"면서 "희귀약의 경우 긴급도입해야 하는 상황이 많은데 GMP현지실사 지연 등으로 허가심사기간이 길어지고 있는 것"이라고 주장했다.
이 관계자는 "유병률이 낮고 희귀한 질병을 치료로 하는 약이 신속하게 허가를 받을 수 있는 제도 개선이 보다 간절하다"며 "GMP심사에서 꼭 중요한 자료를 우선 제출받아 허가절차를 진행, 한시간 급한 환자에게 치료기회를 빠르게 제공해야 한다"고 현실성 있는 신속심사제도를 당부했다.
한편 글로벌의약산업협회 주관한 이날 팜투게더에서는 제약사 15곳에서 참여해 높은 관심도를 나타낸 것으로 전해졌다.
또 식약처는 지난해 4월부터 국내로 수입하는 의약품은 해당 제조국가에서 증명한 제조 및 품질관리기준(GMP) 적합 평가 증명서를 제출해야 하지만 예외적으로 신약과 희귀약의 경우 해당 증명서 제출을 하지 않아도 된다는 내용을 업계에 안내한 것으로 알려졌다.
재심사제도, RMP로 통합..."협의체 통해 구체화 추진" - 뉴스더보이스헬스케어 (newsthevoice.com)
'오늘의 제약뉴스' 카테고리의 다른 글
| 항암제 개발 줄이어...엠에스디-보령 임상 진행 (0) | 2022.06.21 |
|---|---|
| 휴메딕스, 피부-관절-눈 건강에 특화 '삼각편대' 견인 (0) | 2022.06.20 |
| 원자재 가격인상으로 '공급가 인상'...일부 품절도 잇따라 (0) | 2022.06.20 |
| 제조국가 GMP 적합 평가 증명서, 신약-희귀약도 제출? (0) | 2022.06.17 |
| '제약 임상은...ing'...삼진제약 '백혈병치료제' (0) | 2022.06.17 |