최은택 기자/ 승인 2021.11.05 07:46
이진용 심사평가연구소장, 심포지엄서 언급
"가격 내릴 생각 품으면 RWE 활용 안될 것"
심사평가원 '2021 혁신연구 심포지엄'(4)

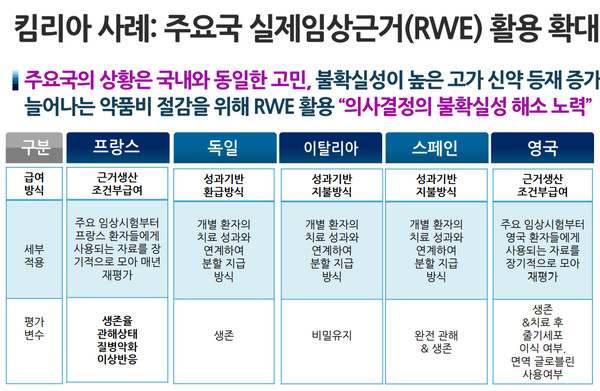
정부와 보험당국이 의약품 급여관리에 활용하기 위해 의욕적으로 추진 중인 실제임상근거(RWE) 제도와와 관련, 심사평가원 고위 관계자가 RWE를 활용해 등재 때보다 효과 개선이 확인되면 신약 가격을 인상해 줘야 한다는 의견을 제시해 관심을 모으고 있다.
주인공은 이진용 심사평가원 심사평가연구소장이다.
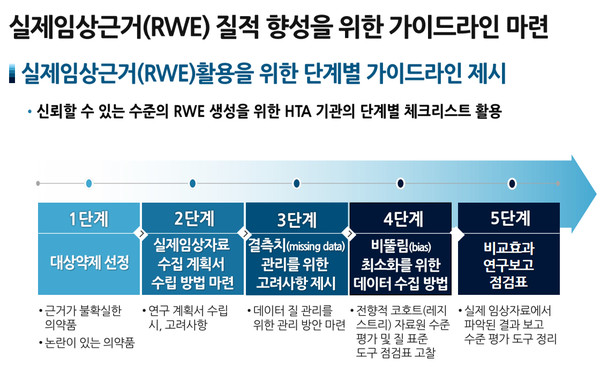
이 소장은 4일 심사평가원이 '의약품 등의 급여관리를 위한 실제임상자료(RWD) 수집체계 구축방안'을 주제로 개최한 '2021 혁신연구 심포지엄' 폐회 인사말을 하면서 이 같이 언급했다.
이 소장은 "RWE는 약제 사후재평가와 관련해서 중요한 이슈이고, 앞으로 논의의 장이 계속 이어질 것 같다. RWE 활용 필요성은 충분히 인식하고 있는데, 제약업계와 환자단체의 우려사항도 분명히 존재한다"고 말했다.
이어 "이걸 꼭해야 되느냐는 기본적인 전제에 동의하면 거기에 맞게 움직여 나가면서, 나머지는 같이 협의해서 가면 될 것이다. (이 때) 스테이크홀더간 의견을 종합해서 같이 가야 하는 것이지 일부가 (끌고) 가는 상황이 되면 안된다"고 했다.
이 소장은 "개인적으로 RWE에 관심을 갖게된 계기는 심사평가원의 전문영역 중 가장 중요한 부분이 될 수 있다고 봤기 때문이다. (이와 관련해서) RWE를 통한 재평가를 통해 가격을 내릴 생각이 마음속에 조금이라도 있으면 이거는 안될 것이라고 우리 연구진에게 말했다"고 했다.
그러면서 "(모든 건) 에비던스에 기반해야 한다. 역으로 말하면 허가시점에는 효과가 40% 정도였는데, RWE로 재평가했더니 80%으로 높아졌다면 심사평가원이 약제가격을 올려줘야 한다고 생각한다"고 했다.
이 소장은 "이게 중요하다. 물론 그렇게 결정될 확율은 별로 없지만 제약업계 입장에서는 내가 신청한 것보다 나빠지면 손해날 확률이 높아질 수 있는데 (아무리) RWD라고 포장하더라도 담당하는 사람 입장에서는 규제라고 생각할 수 밖에 없다"고 했다.
그는 "이 부분은 과학과 스테이크 홀더간 이익과 정책이 맞물린 3가지 아트가 어우러지는 지점이라고 생각하다"며, 스테이크홀더간 의견조정의 중요성을 재차 강조하기도 했다.
http://www.newsthevoice.com/news/articleView.html?idxno=23522
'다양한 보건의료뉴스' 카테고리의 다른 글
| 의료급여엔 있고 건보엔 없는 본인확인 의무화법, 이번엔? (0) | 2021.11.12 |
|---|---|
| 블랙박스 정리 못하는 FDA...JAKi 경고 일관성 상실 (0) | 2021.11.12 |
| "RWE, 환자단위 성과기반 RSA·급여기준 조정 등에 활용" (0) | 2021.11.05 |
| 국회가 주목한 나파벨탄주, 코로나치료제 승인 물꼬 트일까 (0) | 2021.11.01 |
| 건정심 대면의결 신약 30개...연간 재정소요액 2236억 규모 (0) | 2021.10.29 |