- 엄태선 기자/ 승인 2023.10.19 05:59

식약처가 신속한 백신 제품화와 전문인력 양성을 위해 의욕적으로 추진해왔던 백신안전기술지원센터가 '속빈강정'으로 전락할 가능성이 높아졌다.
식약처는 내년도 예산에 백신안전기술지원센터 교육시설 구축 운영비가 반드시 필요하다고 국회에 주문했다.
교육시설 구축 운영비가 확보되지 않을 시 오는 11월말 준공이 완료되는 교육시설을 실제 가동할 수 없다는 것이다. 추가로 필요한 예산 증액은 8억1100원이며 백신 해외인증 인허가 지원 교육시설 구축 운영이 그 명목이다.
식약처는 현재 정부안에는 교육시설 운영을 위한 공공요금 및 제세비용만 편성돼 있어 교육시설 가동을 위한 시설관리용역과 기본경비 등 운영비가 전무하다는 게 그 이유다. 기 편성도니 실습교육 장비 사용에 필요한 시험대 등 설비, 실습생 안전에 필수적인 비상샤워기 등 최소한의 필수 설비 구축을 위한 예산이 필요하다는 부연했다.
여기서 시설관리용역은 센터 교육시설을 운영하기 위한 법정 의무사항인 전기-소방-가스-기기설비 안전관리자 선임이 필요하며 이들을 미선임시 교육시설 가동이 불가하다. 만약 추가 예산이 확보되지 않을 경우 건물만 준공한 후 실제 운영을 하지 못하는 웃지못할 상황에 빠진다는 의미다.
또 교육 운영 업무수행에 필요한 부대비용도 전혀 정부예산에 반영되지 않은 상태라고 지목했다. 컴퓨터나 사무용 가구 등이 필요한데 최소한의 사무용품이 확보되지않아 정상적 교육운영 업무수행이 어렵다고 판단하고 있다.
아울러 실습교육용 시험대나 실습생 안전사고 대비 비상샤워기 등 필요한데 이 또한 예산 확보가 되지 않을 경우 실습교육실시가 불가한 상태다.
식약처는 이같은 교육시설 운영을 위해 기본운영비 4억8500만원과 실습설비 구축비 3억2600만원을 책정해 국회에 예산증액을 요청했다.
한편 백신센터는 신속한 백신 제품화와 해외 인허가 성공에 핵심요소인 전문인력 양성을 위한 현장 중심의 규제-인허가 교육 요구, WHO '글로벌 바이오 인력양성 허브'에 한국이 선정됨에 따라 중-저소득국 대상 백신 규제 전문교육을 내년부터 진행해야 한다.
http://www.newsthevoice.com/news/articleView.html?idxno=34877
'다양한 보건의료뉴스' 카테고리의 다른 글
| 식약처 채용 부적정사례...서류전형 가산점 오류 등 발생 (0) | 2023.10.23 |
|---|---|
| 건강기능식품 섭취시 건강증진 효과는 과연 얼마나? (1) | 2023.10.19 |
| 식약처내 임시조직은?...마약류 오남용 감시단 등 7개 (0) | 2023.10.18 |
| '우리가 지켜야할 필수의약품'...후천성면역결핍증치료제(3) (1) | 2023.10.06 |
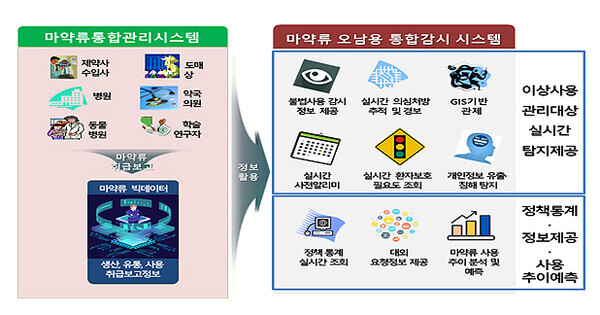
| 심각해지는 '마약류 오남용'...통합감시시스템으로 막는다 (0) | 2023.09.21 |