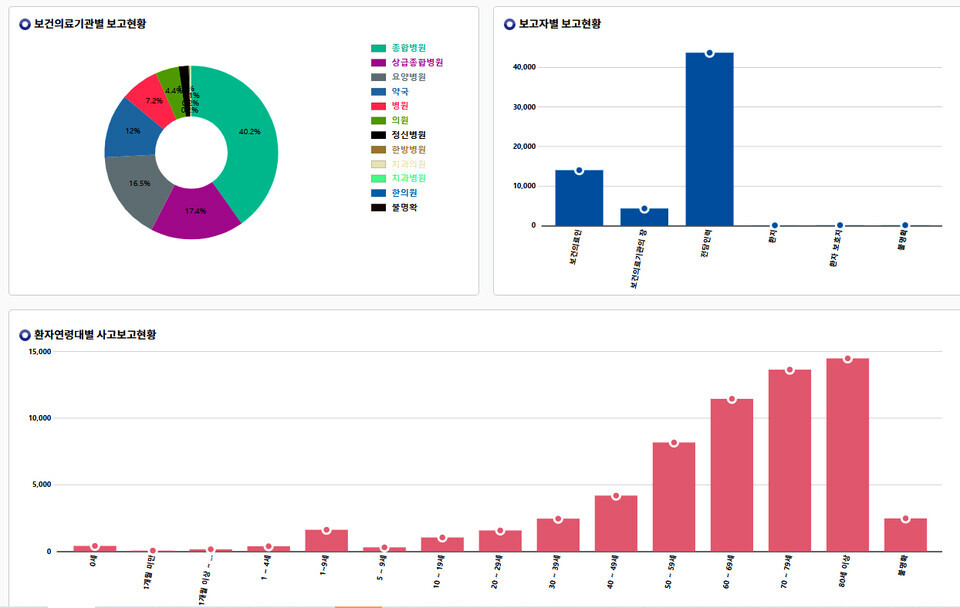
- 엄태선 기자/ 승인 2023.04.13 06:28

치료제 개발을 위한 사람 대상 임상시험이 갈수록 늘어나고 있다. 다국적 제약사는 물론 국내제약사들도 속속 임상시험에 뛰어들면서 신약 등 의약품 개발에 박차를 가하고 있다. 현재 식약처는 이들 제약사들이 신청한 임상정보를 공개하고 있다. 앞으로 '제약임상...ing'를 통해 각 제약사들이 어디에 중점을 두고 의약품 개발을 추진 중인지 임상시험들을 통해 가볍게 소개하고자 한다.
<58>일동제약 'ID120040002(P-CAB)'

최근 몇 년간 모든 역량을 연구개발에 투입하는 국내 제약사가 있다. 연구개발비에 들어가는 규모가 지난해 매출 대비 무려 19.7%인 1251억원까지 늘어나면서 여타 영업활동의 위축(?)까지 이어지고 있지만 여전히 포기하지 않고 전진하고 있다. 미래 성장을 위해서 피할 수 없는 '선택의 길'이라고 판단한 것이다.
최근에는 위산 관련 치료제 개발에 속도를 내고 있다. 위식도 역류 질환이나 소화성 궤양 등에 사용되는 치료제 신약 후보물질 'ID120040002(P-CAB)'에 대한 임상 1상을 진행하고 있다. 지난 2020년부터 연구를 시작한 해당 임상은 국내 특허 5건, 국내 특허등록 1건, 해외특허 1건을 출원한 화학합성신약 후보물질이다.
일동의 임상 진행은 지난 2021년 7월 동물 모델에서 독성 및 효능 평가를 통해 최종 임상 후보물질로 선정했으며 글로벌 CRO 에보텍과 CMC 및 비임상 연구에 대한 협업을 진행, 지난해 11월 임상 1상을 식약처로부터 승인받았다. 이후 임상시험용 의약품의 생산을 끝내고 같은해 12월 임상시험 대상장에게 투약을 완료했다.
일동이 뛰어든 칼륨 경쟁적 위산분비 억제제(P-CAB) 시장은 현재 에이치케이이노엔의 '케이캡'을 비롯해 대웅제약의 '펙수클루'에 이어 제일약품도 온코테라퓨틱스를 통해 임상 3상을 진행중이어서 내년에 관련 제품 출시를 목표하고 있다. 일동제약의 P-CAB 제품 개발은 여타 경쟁 품목에 비해 시기적으로 후발주자인만큼 개발되더라도 시장을 뚫고 자리를 잡기까지는 적지않은 난관이 있을 전망이다.
◆개요
건강한 성인을 대상으로 'ID120040002'를 단회 및 반복 투여 후 안전성, 내약성, 약동학, 약력학적 특성을 평가하기 위한 무작위배정, 이중눈가림, 부분 공개, 위약 및 활성대조, 단계적 증량 1상 임상시험이다. 국내 허가용 개발이며 GI질환이 적응증이다.
◆대조약-시험기간-첫환자
대조약은 ID120040002-TAC1이며 시험기간은 지난해 11월부터 올해 9월까지이다. 목표시험대상자수는 국내 86명이며 첫 시험대상자 선정은 지난해 12월19일이다. 중재군수는 10군이다.
◆투여방법
단회 투여 시험에서는 최소 10시간 금식 후 임상시험용의약품 투여일 오전 9시경 공복 상태에서 배정된 시험약 또는 위약을 단회 경구투여한다. 식이영향 평가시험에서는 최소 10시간 금식 후 임상시험용의약품 투여 30분전부터 표준 고지방식이를 20분이내 전량 섭취 후 오전 9시경 배정된 시험약 또는 위약을 단회 경구투여한다.
반복투여 시험에서는 최소 10시간 금식후 임상시험용의약품 투여일 오전 9시경 공복상태에서 배정된 시험약 또는 위약 또는 활성대조약을 1일 1회 7일간 경구투여하며 시험대상자는 물 200mL와 함께 임상시험용의약품을 통째로 삼켜야 하며, 삼키기 전에 약물을 씹거나 부수지 않아야 한다.
◆환자선정방식
만 19세 이상 50세 이하인 건강한 성인이며 체중이 50kg 이상 90.0kg 이하이면서, 체질량지수(BMI)가 18.0 kg/m2이상 27.0 kg/m2이하인 자, 서면 동의 이후부터 마지막 임상시험용의약품 투여후 90일 후까지 파트너와 시험에서 허용되는 피임법을 사용하고, 90일 후까지 정자, 28일후까지 난자를 기증하지 않기로 반드시 동의한 자가 선정대상이다.
다만 위장관계질환인 크론병, 궤양, 급성 또는 만성 췌장염, 저위산증, 무위산증 등이나 위장관계수술의 과거력이 있는 자 등은 제외된다.
◆시험책임자
단일기관인 서울대병원에서 임상시험을 실시하며 이승환 임상약리학과 교수가 시험책임자이다.
한편 일동제약은 화합합성 신약의 경우 당뇨병치료제를 비롯해 간질환치료제는 임상 1상을, 안구건조증치료제, 간섬유화-간경병 등은 비임상을, 바이오 신약의 경우 황반병성치료제, 여성질염치료제 등은 현재 비임상 단계를 밟고 있다.
'제약 임상은...ing'...일동제약 '소화성 궤양치료제' - 뉴스더보이스헬스케어 (newsthevoice.com)
'오늘의 제약뉴스' 카테고리의 다른 글
| 한독, 제품비중 상승 속 상품비중 낮아져...진단기기 '쑥' (2) | 2023.04.14 |
|---|---|
| '우리가 지켜야할 필수의약품'...조현병치료제 (0) | 2023.04.14 |
| GMP 현지 사후관리 결과...지적사항 외 품목명도 비공개? (0) | 2023.04.11 |
| 제약사 143곳, 품목정리 속도전...1분기 613품목 '역사속으로' (0) | 2023.04.10 |
| 디메틸푸마르산염, 다발성경화증 재발 등 이상사례 발현율 58.72% (0) | 2023.04.07 |